Liczby kwantowe w 10 minut?! Tak! To jest możliwe!
Moi drodzy uczniowie prezentuję Wam notatki, w których znajdziecie liczby kwantowe, bloki energetyczne i konfigurację elektronową. Jak zwykle przejrzyście i z humorem! 🙂
Jestem z nich tak bardzo dumna, że żałuję braku takiego natchnienia w czasach, gdy uczyłam się tego po raz pierwszy. Ale spokojnie dinozaurem (jeszcze) nie jestem, więc wbrew pozorom nie było to AŻ tak dawno. Tak czy inaczej, jestem zadowolona, że mogę się podzielić tą przejrzystą dawką wiedzy z Wami 🙂 Mam nadzieję, że okażą się być dla Was wartościowe.
Proszę dajcie znać jeśli skorzystaliście z tych notatek.
Dzięki temu wiem, że moja praca nie idzie na marne! I dostaję wtedy “powera” by działać dalej.
Sposób na konfigurację elektronową
Ucząc się kolejności konfiguracji elektronowej, weź sobie jakiś notatnik w kratkę i napisz najpierw cyfry od 1 do 7 ale w dół! Następnie, po prawej stronie, o jedno pole niżej, cyfry od 2 do 6, potem od 3 do 5 i w ostatniej linijce 4. Taka piramida na lewej ścianie : )
1
2 2
3 3 3
4 4 4 4
5 5 5
6 6
7
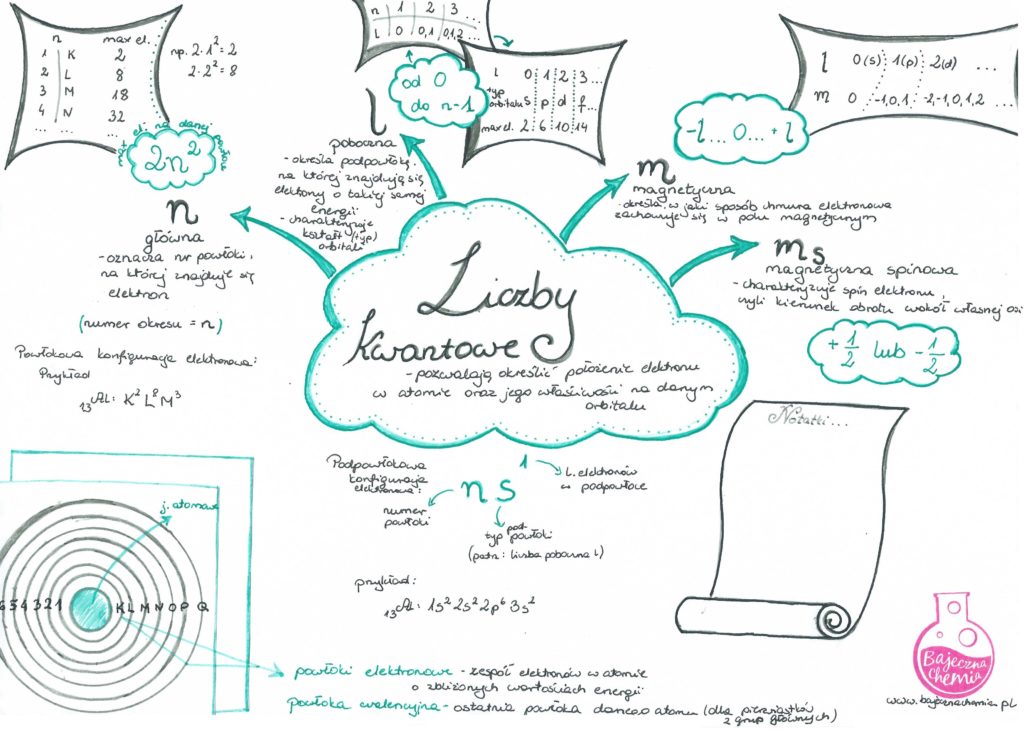
To są główne liczby kwantowe (n) – określają one stan energetyczny układu, w uproszczeniu- energię elektronów. Elektrony o podobnym stanie energetycznym znajdują się na tej samej powłoce elektronowej. Powłoki te mają nieskomplikowaną nazwę – litery z alfabetu – K, L, M, N…
I właśnie tym powłokom możemy przyporządkować liczbę kwantową “n”. Dla K n=1, dla L n=2, dla M n=3, itd. Numer powłoki (główną liczbę kwantową – n) możesz odczytać z układu okresowego pierwiastków, po prostu ukazuje nam to okres. Czyli potas (K) leżąc w 4 okresie – ma cztery powłoki elektronowe, a jego elektrony mogą się znajdują się na powłoce 1, 2, 3 i 4.
Teraz dopiszemy podpowłoki (l- poboczna liczba kwantowa) s, p, d, f .
Jak zapamiętać te litery? Po prostu zapamiętaj te dwa wyrazy: SPADA FIGA! A teraz spójrz na spółgłoski: SPaDa Figa, widzisz s, p, d, f? To nasze orbitale.
W pierwszej kolumnie s, w drugiej p, w trzeciej d, w czwartej f.
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
5s 5p 5d
6s 6p
7s
Teraz w postaci indeksu górnego zapisz ilość elektronów, które każdy z tych orbitali może pomieścić, czyli s – 2, p – 6, d – 10, f – 14. I zostały nam tylko strzałeczki (zobacz w sketchnotce!).
Dzięki nauce szybkiego rysowania takiej piramidki, żaden pierwiastek i jego konfiguracja elektronowa nie będą Ci straszne! Po prostu podążaj za strzałkami i odpowiednią ilością elektronów. W poniższej notatce masz to wyjaśnione na przykładzie arsenu, który ma 33 elektrony.
Ucząc się chemii kwantowej pamiętaj o zakazie Pauliego i Regule Hunda, którą na pewno szybko zapamiętasz dzięki rysunkowi. ; )
Do pobrania:

Życzę Wam, by chemia którą z Wami się dzielę, pomagała w nauce i umilała czas jaki na nią przeznaczacie:)
Pozdrawiam Was serdecznie!




Bardzo kreatywna forma przekazania wiedzy z przymrużeniem oka 😉 Dobra robota, tak trzymaj 🙂
Dziękuję serdecznie, bardzo miło to czytać:) Właśnie tworzę następne kreatywne notatki. 😉
Świetne są te notatki! 😍
Cieszę się, niech służą! :))